今日,國(guó)家藥典委員會(huì)發(fā)布《凡例》、《微生物限度檢查法》等5份國(guó)家標(biāo)準(zhǔn)草案,如下:
-
1107微生物限度標(biāo)準(zhǔn)
-
生物制品分包裝及貯運(yùn)管理
-
凡例
-
動(dòng)物來(lái)源藥用輔料生產(chǎn)和質(zhì)量控制指導(dǎo)原則
-
鼠源性病毒檢查法(4.熒光定量PCR法)

各標(biāo)準(zhǔn)文件內(nèi)容如下:
1107 非無(wú)菌藥品微生物限度標(biāo)準(zhǔn)
非無(wú)菌藥品的微生物限度標(biāo)準(zhǔn)是基于藥品的給藥途徑和對(duì)患者健康潛在的危害以及藥品的特殊性而制訂的。藥品生產(chǎn)、貯存、銷售過(guò)程中的檢驗(yàn),藥用原料、輔料及、中藥提取物及中藥飲片的檢驗(yàn),新藥標(biāo)準(zhǔn)制訂,進(jìn)口藥品標(biāo)準(zhǔn)復(fù)核,考察藥品質(zhì)量及仲裁等,除另有規(guī)定外,其微生物限度均以本標(biāo)準(zhǔn)為依據(jù)。
1.制劑通則、品種項(xiàng)下要求無(wú)菌的及標(biāo)示無(wú)菌的制劑和原輔料 應(yīng)符合無(wú)菌檢查法規(guī)定。
2.用于手術(shù)、嚴(yán)重?zé)齻?yán)重創(chuàng)傷的局部給藥制劑 應(yīng)符合無(wú)菌檢查法規(guī)定。
3.非無(wú)菌化學(xué)藥品制劑、生物制品制劑、不含藥材原粉的中藥制劑的微生物限度標(biāo)準(zhǔn)見(jiàn)表 1。
表1 非無(wú)菌化學(xué)藥品制劑、生物制品制劑、不含藥材原粉的中藥制劑的微生物限度標(biāo)準(zhǔn)

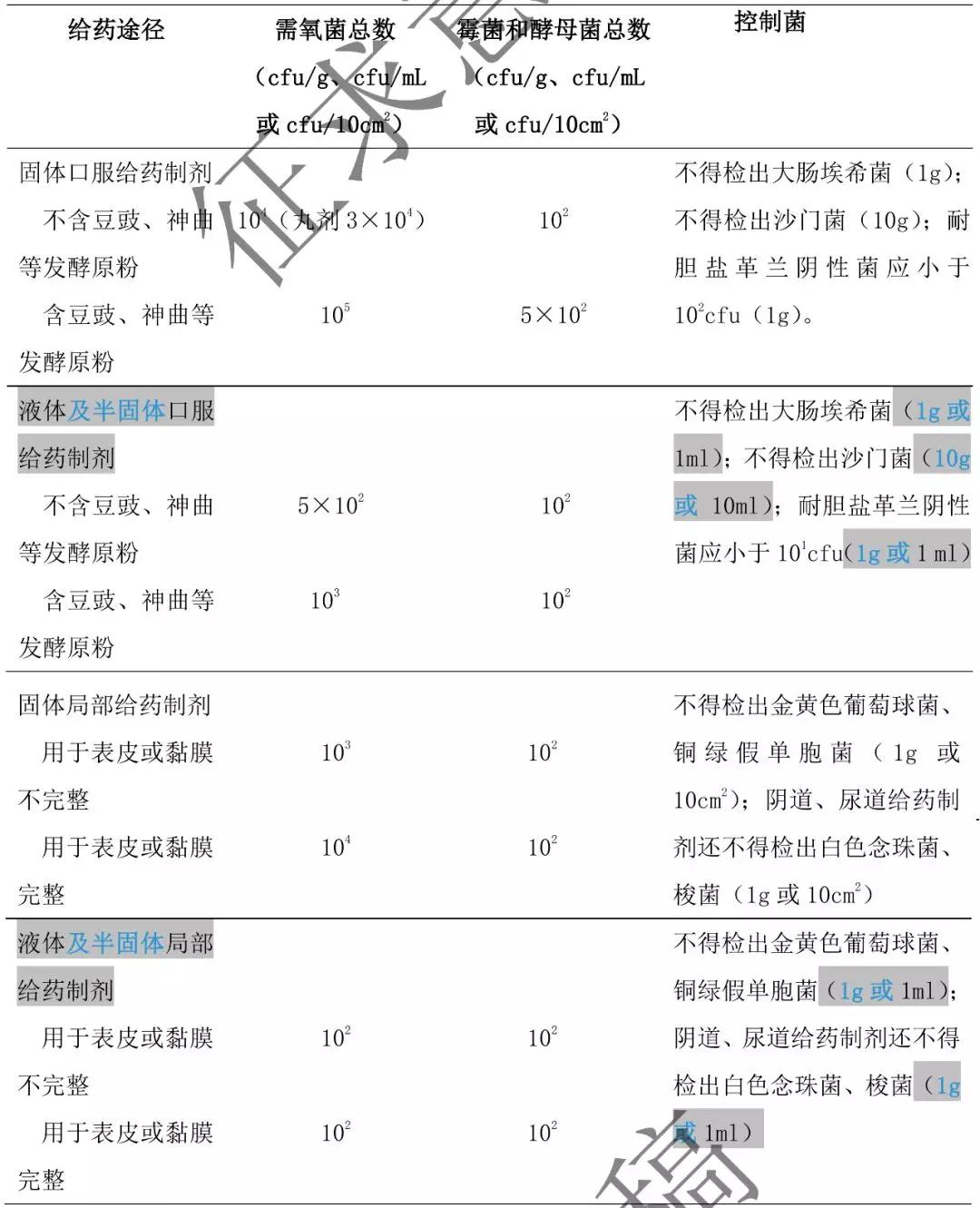
4. 非無(wú)菌含藥材原粉的中藥制劑微生物限度標(biāo)準(zhǔn) 表 2。
表 2 非無(wú)菌含藥材原粉的中藥制劑的微生物限度標(biāo)準(zhǔn)
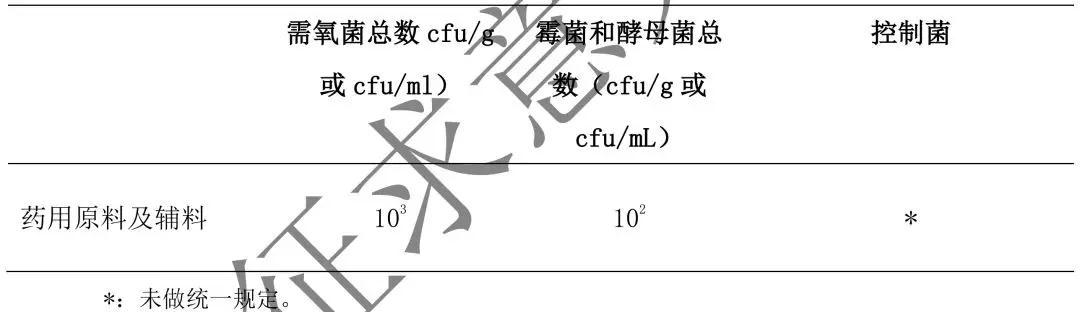
5. 非無(wú)菌的藥用原料及輔料的微生物限度標(biāo)準(zhǔn)見(jiàn)表 3。
表 3 非無(wú)菌藥用原料及輔料微生物限度標(biāo)準(zhǔn)
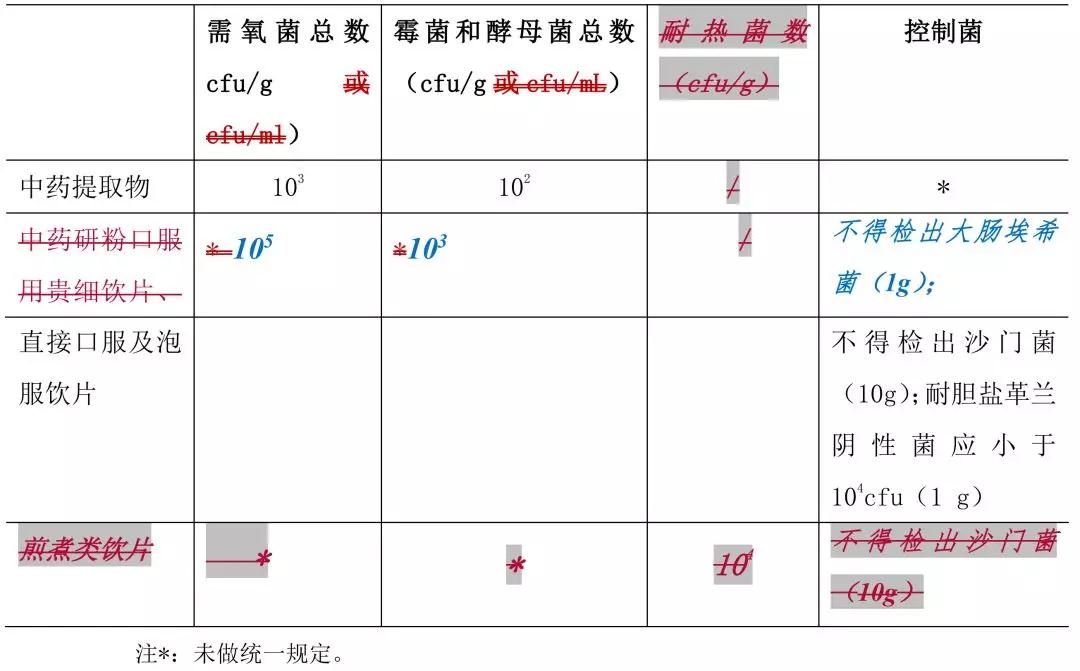
6. 中藥提取物及中藥飲片的微生物限度標(biāo)準(zhǔn)見(jiàn)表 4。
表 4 中藥提取物及中藥飲片的微生物限度標(biāo)準(zhǔn)
7.有兼用途徑的制劑 應(yīng)符合各給藥途徑的標(biāo)準(zhǔn)。
8.除中藥飲片外,非無(wú)菌藥品的需氧菌總數(shù)、霉菌和酵母菌總數(shù)照“非無(wú)菌產(chǎn)品微生物限度檢查:微生物計(jì)數(shù)法(通則 1105)”檢查;非無(wú)菌藥品的控制菌照“非無(wú)菌產(chǎn)品微生物限度檢查:控制菌檢查法(通則 1106)”檢查。各品種項(xiàng)下規(guī)定的需氧菌總數(shù)、霉菌和酵母菌總數(shù)標(biāo)準(zhǔn)解釋如下:
10^1cfu:可接受的最大菌數(shù)為 20;
10^2cfu:可接受的最大菌數(shù)為 200;
10^3cfu:可接受的最大菌數(shù)為 2000:依此類推。
中藥飲片的的需氧菌總數(shù)、霉菌和酵母菌總數(shù)、耐熱菌總數(shù)及控制菌檢查照“中藥飲片微生物限度檢查法”(通則 xxx)檢查;各品種項(xiàng)下規(guī)定的需氧菌總數(shù)、霉菌和酵母菌總數(shù)及耐熱菌數(shù)標(biāo)準(zhǔn)解釋如下:
10^1cfu:可接受的最大菌數(shù)為 50;
10^2cfu:可接受的最大菌數(shù)為 500;
10^3cfu:可接受的最大菌數(shù)為 5000:
10^4cfu:可接受的最大菌數(shù)為 50000:依此類推。
9. 本限度標(biāo)準(zhǔn)所列的控制菌對(duì)于控制某些藥品的微生物質(zhì)量可能并不全面,因此,對(duì)于原料、輔料及某些特定的制劑,根據(jù)原輔料及其制劑的特性和用途、制劑的生產(chǎn)工藝等因素,可能還需檢查其他具有潛在危害的微生物。
10. 除了本限度標(biāo)準(zhǔn)所列的控制菌外,藥品中若檢出其他可能具有潛在危害性的微生物,應(yīng)從以下方面進(jìn)行評(píng)估:
藥品的給藥途徑:給藥途徑不同,其危害不同;藥品的特性:藥品是否促進(jìn)微生物生長(zhǎng),或者藥品是否有足夠的抑制微生物生長(zhǎng)能力;
藥品的使用方法;
用藥人群:用藥人群不同,如新生兒、嬰幼兒及體弱者,風(fēng)險(xiǎn)可能不同;
患者使用免疫抑制劑和甾體類固醇激素等藥品的情況;
存在疾病、傷殘和器官損傷;等等。
11. 當(dāng)進(jìn)行上述相關(guān)因素的風(fēng)險(xiǎn)評(píng)估時(shí),評(píng)估人員應(yīng)經(jīng)過(guò)微生物學(xué)和微生物數(shù)據(jù)分析等方面的專業(yè)知識(shí)培訓(xùn)。評(píng)估原輔料微生物質(zhì)量時(shí),應(yīng)考慮相應(yīng)制劑的生產(chǎn)工藝、現(xiàn)有的檢測(cè)技術(shù)及原輔料符合該標(biāo)準(zhǔn)的必要性。
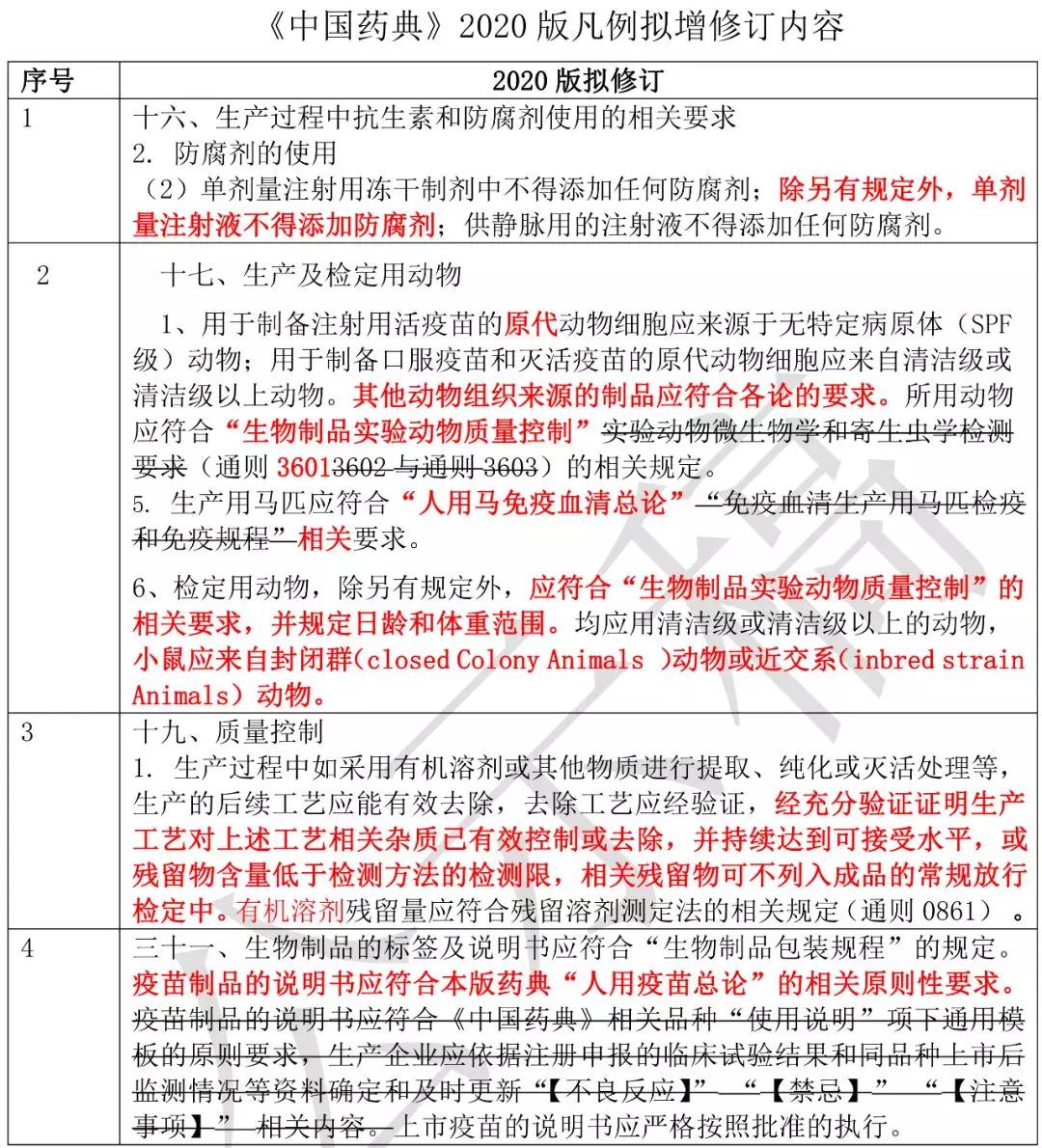
《中國(guó)藥典》 2020 版凡例擬增修訂內(nèi)容
(見(jiàn)下表)
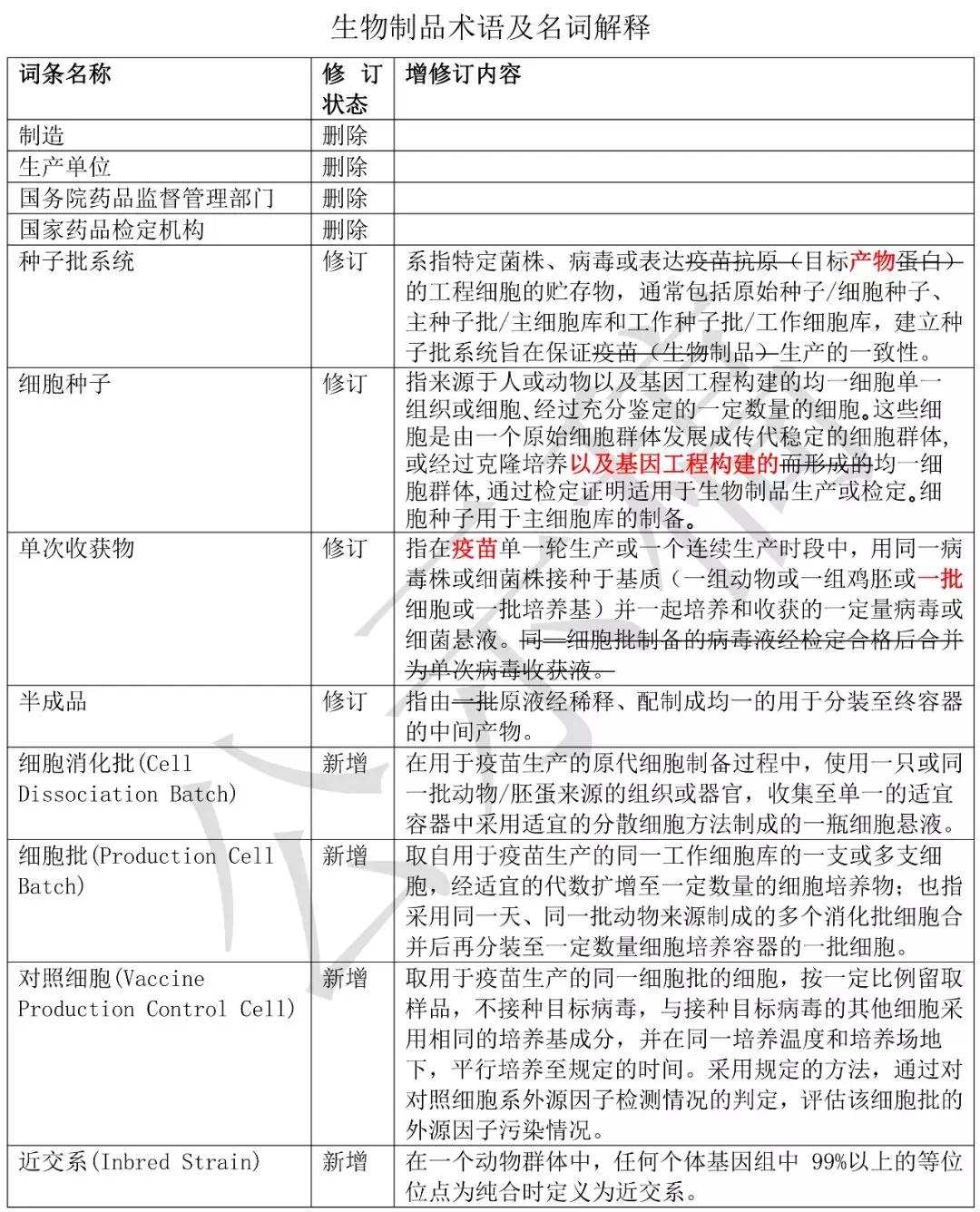
生物制品術(shù)語(yǔ)及名詞解釋
動(dòng)物來(lái)源藥用輔料指導(dǎo)原則
動(dòng)物來(lái)源藥用輔料系指從動(dòng)物組織、器官、腺體、血液、體液、分泌物、皮、骨、角、甲等分離提取的,并經(jīng)充分安全評(píng)估的,能夠 在藥品制劑中添加使用的組分及其加工品。
按原材料來(lái)源分類,動(dòng)物來(lái)源藥用輔料可分為牛 /羊來(lái)源和其他動(dòng)物來(lái)源。按化學(xué)組成分類,動(dòng)物來(lái)源藥用輔料可分為結(jié)構(gòu)明確的單一化合物(如乳糖)、多種結(jié)構(gòu)明確的單一化合物所組成的混合物(如硬脂酸)、比例和/或結(jié)構(gòu)不明確的多組分混合物(如明膠)等。按工藝制法分類,動(dòng)物來(lái)源藥用輔料可分為直接由動(dòng)物來(lái)源原材料制得的分離提取物(如羊毛脂)、分離提取后經(jīng)過(guò)再加工所得的衍生物(如 氫化羊毛脂)等。
動(dòng)物來(lái)源藥用輔料通常具有一定特殊性,如原材料的易腐敗性、可能存在內(nèi)源性殘留物或外源性污染物(如蛋白、微生物、病毒、農(nóng)藥、獸藥等)、組成成分或/和組成比例不明確、特有的對(duì)人體有害成分(如朊蛋白)等,從而可能影響輔料質(zhì)量的批間一致性,甚至引發(fā)不可預(yù)測(cè)的藥品不良反應(yīng)。因此,在藥品制劑中添加使用動(dòng)物來(lái)源藥用輔料時(shí),應(yīng)充分評(píng)估風(fēng)險(xiǎn),明確合理性、必要性和可被替代性。
本 指 導(dǎo) 原 則 僅 對(duì)直接由動(dòng) 物 來(lái) 源 原材料 分 離 提 取 所 得的 藥用 輔料提出相應(yīng)指導(dǎo)原則,以規(guī)范其原材料選擇、生產(chǎn)工藝和過(guò)程控制、質(zhì)量研究和穩(wěn)定性研究、供應(yīng)商審計(jì)等環(huán)節(jié)的質(zhì)量控制,以便盡量降低可能存在的風(fēng)險(xiǎn)。本指導(dǎo)原則不涵蓋非動(dòng)物來(lái)源原材料制得的藥用輔料、由動(dòng)物來(lái)源原材料分離提取后經(jīng)過(guò)再加工所得的藥用輔料和人源性藥用輔料。本指導(dǎo)原則非強(qiáng)制執(zhí)行,企業(yè)應(yīng)基于風(fēng)險(xiǎn)管理的理念, 結(jié)合藥用輔料本身特性及用途開(kāi)展風(fēng)險(xiǎn)評(píng)估及風(fēng)險(xiǎn)防控。
一、原材料的一般要求
動(dòng)物來(lái)源藥用輔料的原材料應(yīng)明確供體動(dòng)物的入選標(biāo)準(zhǔn)(如健康狀況、飼養(yǎng)條件等),一般應(yīng)固定來(lái)源(如牧場(chǎng)、飼養(yǎng)地、屠宰場(chǎng)等)。若發(fā)生變更,應(yīng)重新評(píng)估輔料質(zhì)量及對(duì)下游產(chǎn)品的影響。
動(dòng)物來(lái)源藥用輔料的原材料一般應(yīng)保證動(dòng)物物種或/和種群的同源性,以及取材部位(主要指組織、器官)的一致性。原材料采集后應(yīng)確定批號(hào),并保證可追溯性。對(duì)于已確定批號(hào)的原材料,不得擅自 增加批量,并避免交叉污染。
藥用輔料生產(chǎn)企業(yè)應(yīng)明確原材料供應(yīng)商資質(zhì),并對(duì)原材料質(zhì)量保證提出控制要求,包括動(dòng)物臟器提取的操作過(guò)程、臟器篩選和收集、 貯藏條件、運(yùn)輸條件等。
作為具有較高風(fēng)險(xiǎn)的原材料, 在使用牛/羊源性原材料進(jìn)行藥用輔料生產(chǎn)和加工時(shí),應(yīng)提供 TSE/BSE 潛在風(fēng)險(xiǎn)聲明。牛/羊的不同組織部位具有不同 TSE/BSE 感染性,根據(jù)風(fēng)險(xiǎn)等級(jí),可分為:高感染性組織(如腦、脊髓、視網(wǎng)膜、視神經(jīng)、脊神經(jīng)節(jié)、三叉神經(jīng)節(jié)、腦下垂體、硬腦膜等)、較低感染性組織(如外周神經(jīng)、脾臟、淋巴結(jié)、食道、胎盤(pán)、卵巢、皮膚、肺、肝、腎、血液、奶、尿液等)和無(wú)(檢出)感染性組織(如睪丸、骨、腱、氣管、淚液等)。牛/羊源性原材料一般不得取自高感染性組織;若必須使用,應(yīng)論證該原材料在輔料生產(chǎn)加工中或相關(guān)輔料在制劑生產(chǎn)中的不可替代性,同時(shí)原材料的來(lái) 源地應(yīng)符合相關(guān)部門(mén)的管理規(guī)定。
注釋:TSE 為 Transmissible spongiform encephalopathies 的首字母縮寫(xiě),即可傳播性海綿體腦炎;BSE 為Bovine Spongiform Encephalopathies 的首字母縮寫(xiě),即牛海綿狀腦病。
二、生產(chǎn)工藝和過(guò)程控制
動(dòng) 物 來(lái) 源 藥 用 輔料生 產(chǎn) 工 藝 和 生 產(chǎn)過(guò)程 的 微 小 變 化 可能 導(dǎo)致 輔料物質(zhì)基礎(chǔ)的變化,從而影響輔料本身及下游產(chǎn)品的質(zhì)量,因此應(yīng)嚴(yán)格動(dòng)物來(lái)源藥用輔料的變更管理。若生產(chǎn)工藝發(fā)生變更,應(yīng)告知下游 用戶,并重新評(píng)估輔料質(zhì)量及對(duì)下游產(chǎn)品的影響。
1.生產(chǎn)工藝研究。動(dòng)物來(lái)源藥用輔料的生產(chǎn)工藝的開(kāi)發(fā),應(yīng)考慮粉碎、提取、純化、病毒滅活、滅菌等各環(huán)節(jié),明確工藝過(guò)程的關(guān)鍵環(huán)節(jié)、控制方法和工藝參數(shù),研究并確定參數(shù)范圍,經(jīng)充分驗(yàn)證后,制定操作規(guī)程并嚴(yán)格執(zhí)行,以保證不同批次產(chǎn)品質(zhì)量的一致性。對(duì)環(huán)境(如空氣、溫度等)較為敏感的動(dòng)物來(lái)源藥用輔料,生產(chǎn)過(guò)程應(yīng)根據(jù)影響輔料質(zhì)量的外界因素對(duì)生產(chǎn)工藝進(jìn)行控制,如中間體保存條件、 保存時(shí)間等。
2.外源因子的滅活/去除。動(dòng)物來(lái)源原材料的殘留物及輔料生產(chǎn)過(guò)程中引入的污染物,如細(xì)菌、真菌、支原體、外源性病毒、農(nóng)藥殘留、獸藥殘留、添加劑及抗生素類藥物殘留(如三聚氰胺、孔雀石綠)等,可能在輔料使用時(shí)引起直接的毒副作用、外源因子污染及有害的免疫應(yīng)答,引發(fā)不良反應(yīng)。因此,動(dòng)物來(lái)源藥用輔料的生產(chǎn)應(yīng)盡可能采用滅活/去除外源因子的原材料,否則,應(yīng)在輔料生產(chǎn)過(guò)程中增加能夠有效滅活/去除外源因子的工藝步驟,明確工藝參數(shù),并對(duì)其進(jìn)行驗(yàn)證,以確保工藝的穩(wěn)定性和所得終端產(chǎn)品質(zhì)量的批間一致性,使 滅活/去除的外源因子達(dá)到安全水平。
三、質(zhì)量研究和穩(wěn)定性研究
動(dòng)物來(lái)源藥用輔料的質(zhì)量控制涉及原材料采集、運(yùn)輸、生產(chǎn)和終端產(chǎn)品貯藏、流通、使用等各個(gè)環(huán)節(jié),一般應(yīng)基于風(fēng)險(xiǎn)評(píng)估對(duì)原材料、中間體、終端產(chǎn)品進(jìn)行必要的質(zhì)量研究和穩(wěn)定性研究,建立全過(guò)程質(zhì) 量可追溯體系。
1.質(zhì)量研究。質(zhì)量研究通常可包括理化鑒別、特性分析、功能活性分析、配伍分析等,從而確定相關(guān)的分析方法和限度,并建立與制劑特性和給藥途徑等相匹配的質(zhì)量標(biāo)準(zhǔn)。對(duì)生產(chǎn)過(guò)程中的關(guān)鍵中間體,應(yīng)進(jìn)行質(zhì)量研究并建立質(zhì)量標(biāo)準(zhǔn)。為保證動(dòng)物來(lái)源藥用輔料的安全,應(yīng)對(duì)雜質(zhì)進(jìn)行深入分析和研究,包括潛在的生物活性雜質(zhì);應(yīng)進(jìn)行微生物限度檢查、控制菌檢查和病毒外源因子檢查等;對(duì)生產(chǎn)過(guò)程中可能直接或間接引入的有機(jī)溶劑,應(yīng)保證溶劑殘留符合要求;金屬元素應(yīng)有相應(yīng)控制措施;應(yīng)確定關(guān)鍵質(zhì)量屬性及控制指標(biāo),以評(píng)估藥用輔 料的批間一致性。
2.貯藏。動(dòng)物來(lái)源藥用輔料及其原材料均易受環(huán)境影響,一般應(yīng)選擇合適的包材,并進(jìn)行全面的穩(wěn)定性研究以確定貯藏條件和有效期/復(fù)驗(yàn)期。動(dòng)物來(lái)源藥用輔料包裝完成后即應(yīng)置于規(guī)定的條件下貯藏。四、供應(yīng)商審計(jì)供應(yīng)商審計(jì)范圍和內(nèi)容應(yīng)基于風(fēng)險(xiǎn)評(píng)估,一般包括對(duì)原材料采集和輔料生產(chǎn)、流通、制劑加工等全過(guò)程的審計(jì),并保證相關(guān)記錄可追溯。
對(duì)原材料的供應(yīng)商審計(jì)應(yīng)包括但不限于:動(dòng)物種屬;取材部位;飼養(yǎng)、宰殺、運(yùn)輸過(guò)程;貯藏條件;動(dòng)物檢驗(yàn)檢疫;外源因子、農(nóng)藥、 獸藥殘留的風(fēng)險(xiǎn);供應(yīng)能力等。
對(duì)輔料的供應(yīng)商審計(jì)應(yīng)包括但不限于:生產(chǎn)資質(zhì);生產(chǎn)工藝;工 藝驗(yàn)證;質(zhì)量控制;貯藏條件和運(yùn)輸過(guò)程等。
生物制品分包裝及貯運(yùn)管理
本通用技術(shù)要求規(guī)定了生物制品生產(chǎn)過(guò)程中分批、分裝與凍干、包裝、貯藏 與運(yùn)輸?shù)木唧w要求。除另有規(guī)定外,均應(yīng)符合本通用技術(shù)要求。
一、分批
批 號(hào)系用 以區(qū) 分和識(shí) 別產(chǎn) 品批的 標(biāo)志 , 以 避免發(fā) 生混 淆和差 錯(cuò)。生物制 品 的批號(hào)應(yīng)由質(zhì)量管理部門(mén)審定。
(一)生物制品批號(hào)和亞批號(hào)的編制
1. 批 號(hào) 的 編 碼 順 序 為 “ 年 月 年流 水 號(hào) ” 。年 號(hào)應(yīng) 寫(xiě)公 歷年 號(hào) 4 位 數(shù) , 月 份 寫(xiě) 2 位數(shù)。年流水號(hào)可按生產(chǎn)企業(yè)所生產(chǎn)某制品批數(shù)編 2 位或 3 位數(shù)。某些制品 還可加英文字母或中文,以表示某特定含義。
2. 亞批號(hào)的編碼順序?yàn)?ldquo;批號(hào)-數(shù)字序號(hào)”。如某制品批號(hào)為:200801001,其 亞批號(hào)應(yīng)表示為:200801001-1,200801001-2,……。
3. 同 一批 號(hào) 的 制品 , 應(yīng)來(lái) 源 一致 、 質(zhì)量 均 一 ,按 規(guī) 定 要 求 抽樣 檢 驗(yàn)后 , 能 對(duì)整批制品做出評(píng)定。
(二)批、亞批及批號(hào)確定的原則
1. 成 品批 號(hào) 應(yīng) 在半 成 品配 制 后確 定 ,半 成 品 配制 日 期 即 為 生產(chǎn) 日 期。非 同 曰或同次配制、混合、稀釋、過(guò)濾、分裝的半成品不得作為一批。
2. 制 品的 批 及 亞批 編 制應(yīng) 使 整個(gè) 工 藝過(guò) 程 清 晰并 可 追 溯 , 以最 大 限度 保 證 每批制品被加工處理的過(guò)程是一致的,并且是均質(zhì)的。
3. 單一批號(hào)的亞批編制應(yīng)僅限于以下允許制定亞批的一種情況:
(1) 半成品配制后,在分裝至終容器之前,如須分裝至中間容器,應(yīng)按中間 容器劃分為不同批或亞批;
(2) 半成品配制后,如采用不同濾器過(guò)濾,應(yīng)按濾器劃分為不同批或亞批;(3) 半成品配制后直接分裝至終容器時(shí),如采用不同分裝機(jī)進(jìn)行分裝,應(yīng)按
分裝機(jī)劃分為不同批或亞批;
(4) 半成品配制后經(jīng)同一臺(tái)分裝機(jī)分裝至終容器,采用不同滅菌或滅活設(shè)備 進(jìn)行滅菌或滅活操作、不同凍干機(jī)進(jìn)行凍干,應(yīng)按凍干機(jī)劃分為不同亞批 ;同一 亞批制品分裝、凍干后,如存在進(jìn)一步的工藝處理步驟(例如,血液制品分裝或凍干 后采用 熱處理進(jìn)行病毒滅活),應(yīng)基于該 工藝對(duì)制品質(zhì) 量的影響,對(duì)每 個(gè)處 理單元的制品設(shè)置相應(yīng)的檢測(cè)項(xiàng)目。
4. 同一制品的批號(hào)不得重復(fù);同一制品不同規(guī)格不應(yīng)采用同一批號(hào)。
二、分裝與凍干
本規(guī) 定僅適用 于生物制品的注射劑,其他劑型按“制劑 通則”(通則 0102) 中有關(guān)規(guī)定執(zhí)行。
除另有規(guī)定外,待分裝、冷凍干燥(以下簡(jiǎn)稱凍干)的半成品,須經(jīng)質(zhì)量管 理部門(mén)確認(rèn)或批準(zhǔn)后,方可進(jìn)行分裝或分裝凍干。
(一)分裝、凍干用容器及用具
1. 用 于分 裝 、 凍干 制 品的 最 終容 器 ,其 質(zhì) 量 標(biāo)準(zhǔn) 應(yīng) 符 合 國(guó) 家藥 品 包裝 用 材 料和容器管理的相關(guān)要求。應(yīng)依據(jù)制品特性、包材相容性等選擇適合的內(nèi)包材。
2. 分 裝容 器 及 用具 的 清潔 、 滅菌 處 理工 藝 應(yīng) 經(jīng)驗(yàn) 證 并 確 保 達(dá)到 清 潔、 滅 菌 效果。
3. 接觸不同制品的分裝容器與用具應(yīng)分別清洗。抗血淸類制品、血液制品、 卡介苗、結(jié)核菌素等分裝容器與用具必須專用。
(二)分裝、凍干車間及設(shè)施
1. 分 裝、 凍 干 車間 及 設(shè)施 應(yīng) 符合 現(xiàn) 行中 國(guó) 《 葯品 生 產(chǎn) 質(zhì) 量 管理 規(guī) 范》 的 要 求。
2. 分 裝、 凍 干 設(shè)備 的 規(guī)格 和 相關(guān) 技 術(shù)參 數(shù) 應(yīng) 滿足 生 產(chǎn) 工 藝 的要 求 ,設(shè) 備 表 面便于清潔消毒,與制品直接接觸部件便于拆卸、清潔、滅菌和再利用。
3. 以下情況不得使用同一分裝間和分裝、凍干設(shè)施進(jìn)行分裝、凍干:
(1) 預(yù)防類生物制品與治療類生物制品;
(2) 不同給藥途徑的疫苗;
(3) 減毒活疫苗與滅活疫苗;
(4) 病毒去除和(或)滅活處理前后與的血液制品。
4. 不 同 品種 及 規(guī)格 制品 交 替 使用 同一 分裝 間和 分裝 、 凍 干 設(shè)施 時(shí) 應(yīng) 進(jìn) 行 共 線使用的風(fēng)險(xiǎn)評(píng)估;在一種制品分裝后,必須進(jìn)行有效的清潔和消毒,清潔效果 應(yīng)定期驗(yàn)證。
(三)人員
1. 直 接參 加 分 裝、 凍 干的 人 員, 每 年至 少 應(yīng) 做 1 次 健 康檢 查。凡患 有活 動(dòng) 性結(jié)核、病毒性肝炎或其他可能污染制品的傳染病患者,不得參加分裝 、凍干工 作。
2. 從 事分 裝 、 凍干 的 操作 人 員應(yīng) 經(jīng) 嚴(yán)格 培 訓(xùn) ,考 核 合 格 后 上崗 ;每次 進(jìn) 入 分裝、凍干生產(chǎn)區(qū)域的人員應(yīng)嚴(yán)格限定數(shù)量。
(四)待分裝半成品的規(guī)定
1. 半 成品 自 配 制完 成 至分 裝 的放 置 時(shí)間 應(yīng) 經(jīng) 驗(yàn)證 , 除 另 有 規(guī)定 外 ,一 般 應(yīng) 不超過(guò)規(guī)定的檢定時(shí)間。
2. 待 分裝 制 品 的標(biāo) 識(shí) 必須 完 整、 明 確, 標(biāo) 識(shí) 內(nèi)容 至 少 應(yīng) 包 括品 名 、批 號(hào) 、 配制時(shí)間、最晚分裝時(shí)間及分裝時(shí)限。
3. 存 放待 分 裝 制品 的 容器 應(yīng) 密封 且 無(wú)破 損 , 存放 和 轉(zhuǎn) 移 過(guò) 程應(yīng) 采 取嚴(yán) 密 的 防污染措施。
(五)分裝要求
1. 分 裝設(shè) 備 和 無(wú)菌 分 裝工 藝 應(yīng)經(jīng) 驗(yàn) 證;除 菌 過(guò)濾 系 統(tǒng) 應(yīng) 進(jìn) 行完 整 性測(cè) 試 的 驗(yàn)證。
2. 分 裝前 應(yīng) 加 強(qiáng)核 對(duì) ,防 止 錯(cuò)批 或 混批 。分 裝規(guī) 格 或 制 品 顏色 相 同而 品 名 不同的制品不得在同室同時(shí)分裝。
3. 分 裝過(guò) 程 應(yīng) 嚴(yán)格 按 照無(wú) 菌 操作 的 要求 進(jìn) 行 ,應(yīng) 進(jìn) 行 全 過(guò) 程的 微 生物 和 懸 浮粒子動(dòng)態(tài)監(jiān)測(cè)并符合要求。
4. 除另有規(guī)定外, 制品應(yīng)盡量采用原容器直接分裝,同一容器的制品,應(yīng) 根據(jù)驗(yàn)證結(jié)果,規(guī)定分裝時(shí)間,最長(zhǎng)不超過(guò) 24 小時(shí)。
5. 液體制品分裝后立即密封,凍干制品分裝后應(yīng)立即凍干。除另有規(guī)定外, 應(yīng)采取減壓法或其他適宜的方法進(jìn)行容器密閉性檢查。用減壓法時(shí),應(yīng)避免將安 瓿泡入液體中。經(jīng)熔封的制品應(yīng)逐瓶進(jìn)行容器密封性檢查,其他包裝容器的密封 性應(yīng)進(jìn)行抽樣檢查。
6. 活 疫苗 及 其 他對(duì) 溫 度敏 感 的制 品 ,在 分 裝 過(guò)程 中 制 品 的 溫度 應(yīng) 根據(jù) 相 關(guān) 驗(yàn) 證試 驗(yàn) 和 穩(wěn)定性 考察 結(jié)果 確定 ,最 高不 得 超過(guò) 25°C 。除另 有規(guī) 定外, 分裝 后 的制品應(yīng)盡快移入 2?8℃環(huán)境貯存。
7. 混懸狀制品或含有吸附劑的制品,在分裝過(guò)程中應(yīng)保持混合均勻。
8. 制品實(shí)際分裝量:
(1)瓶裝 液體制 品的實(shí)際裝量應(yīng)多于 標(biāo)簽標(biāo) 示量,應(yīng)根據(jù)所選用 最終容 器 的尺寸,以及待分裝制品溶液黏度的不同,適度補(bǔ)加裝量,以保證每瓶的抽出量 不 低于 標(biāo) 簽 上 所 標(biāo) 示 的 數(shù) 量 。如 , 分裝 100ml 者 可補(bǔ) 加 4.0ml ;分 裝 50ml 者 可 補(bǔ)加 1.0ml;分裝 20ml 者可補(bǔ)加 0.60ml;分裝 10ml 者可補(bǔ)加 0.50ml;分裝 5ml 者 可 補(bǔ) 加 0.30ml ;分 裝 2ml 者 可 補(bǔ) 加 0.15ml ;分 裝 1ml 者可 補(bǔ) 加 0.10ml;分 裝 0.5ml 者可補(bǔ)加 0.10ml;
(2)預(yù)裝式注射器制品的實(shí)際裝量應(yīng)不低于標(biāo)示量。
(六)凍干要求
1. 應(yīng) 根據(jù) 制 品 的不 同 特性 研 究確 定 凍干 工 藝 。凍 干 設(shè) 備 及 工藝 應(yīng) 按實(shí) 際 凍 干批量進(jìn)行驗(yàn)證。凍干過(guò)程應(yīng)有自動(dòng)掃描記錄。凍干全過(guò)程應(yīng)嚴(yán)格無(wú)菌操作。
2. 真 空封 口 者 應(yīng)在 成 品檢 定 中測(cè) 定 真空 度 。充氮 封 口 應(yīng) 充 足氮 量 ,氮 氣 標(biāo) 示純度應(yīng)不低于 99.99%。
(七)分裝、凍干標(biāo)識(shí)和記錄
1. 分裝、凍干后之制品應(yīng)有標(biāo)識(shí),內(nèi)容至少包括:制品名稱、批號(hào)、規(guī)格、 數(shù)量、分裝或凍干日期等。
2. 分 裝記 錄 應(yīng) 包括 分 裝器 具 和過(guò) 濾 系統(tǒng) 的 滅 菌處 理 記 錄 和 過(guò)濾 系 統(tǒng)的 完 整 性測(cè)試結(jié)果等。
(八)抽樣、檢定
1. 成 品應(yīng) 每 批 抽樣 進(jìn) 行全 檢 ,如 分 亞批 , 應(yīng) 根據(jù) 亞 批 編 制 的情 況 確定 各 亞 批需分別進(jìn)行檢測(cè)的項(xiàng)目。
2. 抽 樣應(yīng) 具 有 代表 性 ,應(yīng) 在 分裝 過(guò) 程的 前 、 中、 后 階 段 或 從凍 干 柜不 同 板 層、不同位點(diǎn)進(jìn)行抽樣;分裝過(guò)程中如發(fā)生可能影響制品質(zhì)量的偏差時(shí) ,抽樣還 應(yīng)包括對(duì)發(fā)生上述偏差的適當(dāng)階段抽取的樣品。
3. 根據(jù)實(shí)際生產(chǎn)情況,成品檢定部分項(xiàng)目可在貼簽或包裝前抽樣進(jìn)行檢定。
三、包裝
生 物 制 品 包 裝 涉 及 的 說(shuō) 明 書(shū) 及 標(biāo) 簽 管 理 應(yīng) 符 合 國(guó) 家 藥 品 監(jiān) 督 管 理 部 門(mén) 的 相 關(guān)規(guī)定。
(一)包裝車間要求
1. 包 裝 車間 的 設(shè)施 及包 裝 材 料應(yīng) 符合 中國(guó) 現(xiàn)行 《藥 品 生 產(chǎn) 質(zhì)量 管 理 規(guī) 范 》 要 求。包 裝 車 間 應(yīng)干 凈整 潔, 環(huán) 境溫 度應(yīng) 不 高于 25 ℃ 。如 制品 貯存 溫度 與包 裝環(huán)境溫度不一致,應(yīng)通過(guò)驗(yàn)證確定包裝時(shí)限。
2. 已分裝或凍干后制品,經(jīng)質(zhì)量管理部門(mén)審核并確認(rèn)后,方可進(jìn)行包裝。2. 同 一 車間 有 數(shù)條 包裝 生 產(chǎn) 線同 時(shí)進(jìn) 行包 裝時(shí) ,各 包 裝 線 之間 應(yīng) 有 隔 離 設(shè)施。外觀相似的制品不得在相鄰的包裝線上包裝。每條包裝線均應(yīng)標(biāo)明正在包裝 的制品名稱及批號(hào)。
(二)燈視檢查(以下簡(jiǎn)稱燈檢)
1. 除 另有 規(guī) 定 外, 熔 封后 的 安瓿 或 密封 的 分 裝容 器, 在燈 檢 前 應(yīng)進(jìn) 行容 器 密封性檢查。
2. 制 品在 包 裝 前應(yīng) 按 照各 論 中的 要 求進(jìn) 行 外 觀檢 查 , 制 品 燈檢 應(yīng) 符合 以 下 要求:
(1) 人工燈檢
① 燈檢應(yīng)采用日光燈(光照度應(yīng)為 1000?3000lx),其背景和光照度按制品 的性狀調(diào)整;
② 燈檢人員的視力應(yīng)每半年檢査一次,視力應(yīng)在 4.9 或 4.9 以上,矯正視力 應(yīng)在 5.0 或 5.0 以上,無(wú)色盲;
③ 凡制 品顏色 或澄明度異常、有異 物或有 搖不散的凝塊、有結(jié) 晶析出 、封 口不嚴(yán)、有黑頭或裂紋等應(yīng)全部剔除,有專門(mén)規(guī)定者應(yīng)按相關(guān)各論執(zhí)行。
(2) 全自動(dòng)燈檢
應(yīng)對(duì)相關(guān)設(shè)備進(jìn)行驗(yàn)證,并對(duì)比評(píng)估全自動(dòng)燈檢和人工燈檢的檢測(cè)效能(如 Knapp-Kushner 測(cè)試),設(shè)備使用前應(yīng)進(jìn)行校準(zhǔn)和檢查。
(三)標(biāo)簽和藥品說(shuō)明書(shū)
1. 藥 品包 裝 標(biāo) 簽和 說(shuō) 明書(shū) 的 體例 、 規(guī)范 和 編 寫(xiě)印 制 應(yīng) 符 合 《中 華 人民 共 和 國(guó)藥品管理法》及國(guó)家藥品監(jiān)督管理部門(mén)的有關(guān)規(guī)定。
1.藥品說(shuō)明書(shū)應(yīng)與國(guó)家藥品監(jiān)督管理部門(mén)批準(zhǔn)的內(nèi)容一致。
2.藥品包裝標(biāo)簽的文字表述應(yīng)以藥品說(shuō)明書(shū)為依據(jù),不得超出說(shuō)明書(shū)內(nèi)容, 不得加入無(wú)關(guān)的文字和圖案。
4. 應(yīng) 在說(shuō) 明 書(shū) 中載 明 必要 的 風(fēng)險(xiǎn) 提 示, 以 警 示臨 床 使 用 , 如本 品 為皮 內(nèi) 注 射, 嚴(yán)禁皮 下或肌肉注射(如:皮內(nèi)注射用卡介苗);人血液制 品應(yīng)注 明病毒安 全性風(fēng)險(xiǎn)提示供臨床使用時(shí)權(quán)衡利弊。
5. 生 產(chǎn)過(guò) 程 使 用抗 生 素、 甲 醛、 裂 解劑 等 原 材料 時(shí) , 應(yīng) 在 制品 的 說(shuō)明 書(shū) 中注明對(duì)所用原材料過(guò)敏者不得使用的相關(guān)警示語(yǔ)。
(四)包裝
1. 已分裝或凍干后制品,經(jīng)質(zhì)量管理部門(mén)審核并確認(rèn)后,方可進(jìn)行包裝。
2. 包 裝 前, 應(yīng) 按質(zhì) 量管 理 部 門(mén)發(fā) 出的 包裝 通知 單所 載 明 的 相關(guān) 內(nèi) 容 ( 如 品名、批號(hào)、有效期等)準(zhǔn)備瓶簽或印字戳。瓶簽上的字跡應(yīng)清楚。
3. 包 裝過(guò) 程 中 應(yīng)仔 細(xì) 核對(duì) 相 關(guān)信 息 ,防 止 錯(cuò) 誤和 混 淆 。在 包裝 過(guò) 程中 , 如 發(fā)現(xiàn)制品的外觀異常、容器破漏或有異物者應(yīng)剔除。
4. 瓶 簽應(yīng) 與 容 器貼 實(shí) ,不 易 脫落 , 瓶簽 內(nèi) 容 不得 用 粘 貼 或 剪貼 的 方式 進(jìn) 行 修改或補(bǔ)充。直接印字的制品字跡應(yīng)清楚。
5. 不 同制 品 或 同一 制 品不 同 規(guī)格 , 其瓶 簽 應(yīng) 采用 不 同 顏 色 或式 樣 ,以 便 于 識(shí)別。
6. 每個(gè)最小包裝盒內(nèi)均應(yīng)附有藥品說(shuō)明書(shū)。
7. 外 包裝 箱 標(biāo) 簽內(nèi) 容 應(yīng)直 接 印在 包 裝箱 上 。批號(hào) 和 有 效 期 采用 打 碼機(jī) 直 接 打印在包裝箱上,字跡應(yīng)清楚,不易脫落和模糊。
8. 制 品包 裝 全 部完 成 后, 應(yīng) 及時(shí) 清 場(chǎng)并 填 寫(xiě) 清場(chǎng) 記 錄 , 同 時(shí)應(yīng) 對(duì) 包裝 材 料 和制品數(shù)量進(jìn)行物料平衡計(jì)算;完成包裝的成品應(yīng)及時(shí)交送成品庫(kù)。
四、貯藏與運(yùn)輸
生物制品貯藏和運(yùn)輸管理應(yīng)符合國(guó)家對(duì)藥品流通和運(yùn)輸?shù)南嚓P(guān)要求。本規(guī)定適用于生物制品成品的貯藏和運(yùn)輸管理。中間品、原液、半成品的貯藏和運(yùn)輸管理應(yīng)符合本版藥典各論或批準(zhǔn)的要求。
(一)生物制品貯藏管理要求
1. 制 品的 貯 藏 條件 ( 包括 溫 、濕 度 ,是 否 需 避光 ) 應(yīng) 經(jīng) 驗(yàn) 證, 并 符合 相 關(guān) 各論或批準(zhǔn)的要求,除另有規(guī)定外,貯藏溫度為 2~8°C。
2. 應(yīng) 配備 專 用 的冷 藏 設(shè)備 或 設(shè)施 用 于制 品 貯 藏, 并 按 照 現(xiàn) 行《 藥 品生 產(chǎn) 質(zhì) 量管理規(guī)范》的要求劃分區(qū)域,并分門(mén)別類有序存放。
(1) 倉(cāng)儲(chǔ)區(qū)的設(shè)計(jì)和建造應(yīng)合理。倉(cāng)儲(chǔ)區(qū)應(yīng)當(dāng)有足夠的空間,確保有序貯藏 成品;
(2) 倉(cāng)儲(chǔ)區(qū)的貯存條件應(yīng)符 合制品規(guī)定的條件(如溫、濕度,避光 )和安全 要求,應(yīng)配備用于冷藏設(shè)備或設(shè)施的溫度監(jiān)控系統(tǒng);
(3) 應(yīng)對(duì)冷庫(kù),儲(chǔ)運(yùn)溫、濕度監(jiān)測(cè)系統(tǒng)以及冷藏運(yùn)輸?shù)脑O(shè)施或設(shè)備進(jìn)行使用前驗(yàn)證、使用期間的定期驗(yàn)證及停用時(shí)間超過(guò)規(guī)定時(shí)限的驗(yàn)證;
(4) 應(yīng)由專人負(fù)責(zé)對(duì)貯存、運(yùn)輸設(shè)施設(shè)備進(jìn)行定期檢查、清潔和維護(hù) ,并建 立記錄和檔案。
3. 應(yīng) 建 立制 品 出入 庫(kù)記 錄 , 應(yīng)建 立成 品銷 售、 出庫(kù) 復(fù) 核 、 退回 、 運(yùn) 輸 、 不 合格藥品處理等相關(guān)記錄,記錄應(yīng)真實(shí)、完整、準(zhǔn)確、有效和可追溯。
(二)生物制品運(yùn)輸管理要求
1. 生 物制 品 中 所含 活 性成 分 對(duì)溫 度 敏感 , 應(yīng) 在規(guī) 定 的 運(yùn) 輸 條件 下 采用 最 快 速的運(yùn)輸方式,縮短運(yùn)輸時(shí)間.
2. 除 另 有 規(guī)定 外, 應(yīng) 采用 冷鏈 運(yùn) 輸 。冷 鏈 運(yùn)輸 ,即 運(yùn)輸 全 過(guò) 程, 包括 裝 卸 搬運(yùn)、轉(zhuǎn)換運(yùn)輸方式,外包裝箱組裝與拆除等環(huán)節(jié),都能使制品始終保持在一定 溫度下。疫苗冷鏈運(yùn)輸應(yīng)符合國(guó)家相關(guān)規(guī)定。
3. 采 用冷 鏈 運(yùn) 輸時(shí) , 應(yīng)對(duì) 冷 鏈運(yùn) 輸 設(shè)施 或 設(shè) 備進(jìn) 行 驗(yàn) 證 , 并定 期 進(jìn)行 再 驗(yàn) 證;應(yīng)由專人負(fù)責(zé)對(duì)冷鏈運(yùn)輸設(shè)施設(shè)備進(jìn)行定期檢查、清潔和維護(hù),并建立記錄 和檔案。
4. 制 品的 運(yùn) 輸 溫度 應(yīng) 符合 各 論或 批 準(zhǔn)的 溫 度 要求 , 溫 度 范 圍的 確 定應(yīng) 依 據(jù) 制品的穩(wěn)定性試驗(yàn)的驗(yàn)證結(jié)果。
5. 運(yùn)輸時(shí)應(yīng)避免運(yùn)輸過(guò)程中震動(dòng)對(duì)制品質(zhì)量的影響。
6. 生 物制 品 運(yùn) 輸過(guò) 程 中可 能 存在 難 以避 免 的 短暫 脫 冷 鏈 時(shí) 間, 應(yīng) 依據(jù) 脫 冷 鏈時(shí)間和溫度對(duì)制品質(zhì)量影響的相關(guān)研究,確定可允許的脫冷鏈時(shí)間和可接受的 溫度限度。





